- Главная
- Публикации о Коллапане
- Стоматология
- Функциональная инъекционная остеопластика челюстной кости
Публикации о Коллапане
ФУНКЦИОНАЛЬНАЯ ИНЪЕКЦИОННАЯ ОСТЕОПЛАСТИКА ЧЕЛЮСТНОЙ КОСТИ
Л.Н. Гурфинкель - врач-стоматолог-имплантолог высшей категории, член Секции Дентальной Имплантологии СтАР, заслуженный изобретатель России, академик РАМТН, член Нанотехнологического общества России, научный консультант «Инновационно-стоматологического Центра НАНО-ДЕНТ», г. Москва
Р.М. Гизатуллин - главный врач Инновационного стоматологического центра «НАНО-ДЕНТ», г Москва, академик РАМТН
Проблема атрофии костной ткани после удаления зубов является одним из важнейших вопросов современной стоматологии, так как значительная атрофия костной ткани челюстей делает невозможным проведение внутрикостной имплантации, а также создает серьезные трудности при ортопедическом лечении пациентов с использованием съёмных и несъёмных протезов.
Уменьшение объема альвеолярного гребня вследствие прогрессирующей атрофии костной ткани снижает возможности применения внутрикостной имплантации из-за высокой степени вероятности повреждения нижнечелюстного нерва, перфорации дна и разрыва слизистой оболочки верхнечелюстной пазухи (Никитин А. А., 2002; Иванов С. Ю. и др., 2003; Робустова Т. Г. и др., 2003).
Достаточные высота и ширина альвеолярного отростка также важны для оптимального восстановления функциональной и эстетической функции зубов. По данным Е.Вайнштейн и соавт. (1993), неточность определения высоты альвеолярного отдела челюсти является причиной 28% осложнений.
Известно, что альвеолярная кость, лишенная своей основной опорной функции, всегда подвергается атрофии после удаления зубов. Особенно атрофия выражена при осложненном заживлении лунки (Татинцян В. Г. и соавт., 1991). А. Ashman (1997) пришел к выводу, что в течение 3 лет после удаления зуба объем альвеолярной кости уменьшается на 40 — 60%. Затем этот атрофический процесс продолжается, и убыль кости составляет от 0,5% до 1% от ее объема в год.
Несмотря на достигнутые успехи, проблема выбора методов и материалов для увеличения костной ткани альвеолярного отростка при протезировании с использованием дентальных имплантатов до конца не решена, так как при этом необходимо учитывать морфофункциональные особенности костной ткани в конкретной клинической ситуации.
Учитывая, что результат хирургического вмешательства зависит от ряда факторов, таких как локализация и протяженность дефекта зубного ряда, степень атрофии костной ткани в зоне дефекта, выбор применяемых остеопластических материалов, необходим определённый алгоритм выбора метода остеопластики.
Причинами дефектов зубных рядов во фронтальном отделе с наличием дефицита костной ткани являются чаще всего травмы или травматические удаления зубов и их корней. При травме во фронтальном отделе происходит перелом тонкой наружной кортинальной пластинки, или при осложнённом кариесе она скусывается щипцами при некорректном удалении корней.
Дефицит костной ткани в подобных случаях бывает на верхней челюсти больше, чем на нижней, в силу меньшей плотности верхнечелюстной кости.
Атрофия альвеолярных отростков в боковых отделах челюстей обусловлена чаще всего адентией и, как следствие, прогрессирующей гипотрофией костной ткани и, при отсутствии своевременной коррекции, переходом детерминированного гиперфункцией параморбидного адаптационного синдрома костной ткани пародонта в стадию декомпенсации, т. е. — в атрофию.
С целью аугментации чаще всего применяются:
— синуслифтинг (классический и щадящий);
— синуспак (антропластика);
— костная пластика аутотрансплантатом;
— направленная регенерация костной ткани.
В качестве костнопластических материалов при перечисленных операциях используются аутокость, аллогенная кость, ксенокость, остеоиндуктивные материалы.
Наиболее положительные результаты достигаются при применении аутокости, не вызывающей иммунной реакции.
Однако все эти методы страдают одним общим недостатком — травматизацией в ходе их применения.
С целью снижения травматичности и оптимизации процесса регенерации костной ткани на участке проводимой остеопластики в ИСЦ «НАНО-ДЕНТ» используется функционально-инъекционный метод остеопластики челюстной кости.
Теоретическим обоснованием этого метода является закон, сформулированный Wolff J. (1872), о том, что в основе каждой регенерации лежит стремление природы восстановить не форму, а функцию.
Roux W. (1893), в свою очередь, обосновал, что кость имеет функциональные форму и строение, и происходит это оттого, что функциональное раздражение вызывает трофическое раздражение клеток, в результате чего увеличивается питание кости; увеличение ведёт и к увеличению органа, уменьшение, наоборот, ведёт к атрофии.
Соковым Л. П. (2002) обосновано учение о парамобитных адаптационных синдромах — продолжение учения Г. Селье об адаптационном синдроме.
Алгоритм действий
В месте проведения инъекционной остеопластики (например, при синуслифтинге) в челюстной кости высверливается канал диаметром 2,3 мм и глубиной 3 — 7 мм. В этот канал с усилием вворачивается имплантат для проведения остеопластики, представляющий собой втулку, выполненную в виде полого цилиндра с винтом-дистрактором, имеющим шлиц под отвёртку.
По всей длине втулка имеет с внешней стороны агрессивную резьбу для фиксации имплантата в костной ткани, а во внутреннем сквозном отверстии втулки выполнена резьба для сопряжения с резьбой винта-дистрактора или иглой шприца. В кость имплантат вворачивается на глубину 2 — 3 мм (в кортикальный слой), при этом торцевая часть имплантата с элементом фиксации «под ключ» находится в слизистой оболочке (или выступает над ней). Затем проводится непосредственно остеотомия никелид-титановыми микроостомами с памятью формы, заранее изготовленными из проволоки сплава TiNi-10, диаметром 1 мм, длиной 20 — 25 мм.
Отшлифованная часть остеотома фиксируется в держателе прижимным винтом, затем выпрямляется при низкой температуре и в этом (мартенситном) состоянии вводится в отверстие установленного имплантата до упора держателя в наружную часть имплантата. После чего вращательными движениями на заданный анатомо-топографическими параметрами угол проводится остеотомия губчатого вещества кости либо (в случае синуслифтинга) отслоение слизисто-надкостничного лоскута с целью создания полости для последующего введения жидкого остеопластического материала (рис. 1, 2, 3).
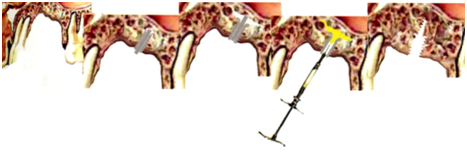
рис.1
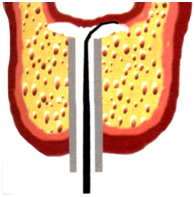
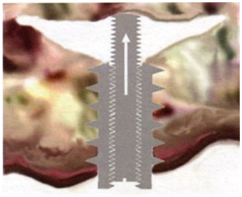
рис.2 рис.3
Затем фиксатор извлекается, а во внутреннюю резьбу имплантата ввинчивается игла шприца с «КоллапАН-гелем». В сформированную полость под давлением вводится необходимый для остеопластики объем геля. После извлечения иглы в имплантат до упора (при остеотомии) в кость ввинчивается винт-дистрактор, предупреждая отток геля через имплантат и создавая необходимое напряжение для замещения материала костным регенератом.
Эти манипуляции при необходимости повторяются с интервалом 3 — 4 недели (под R-контролем). Дистрактор на время инъекции (или повторной остеотомии) извлекается, а затем вновь активируется путем вкручивания до упора.
Гидроксиапатита аморфный наноструктурированный гель (ГАНГ) с высокой концентрацией действующего вещества (до 80%), обладающий тиксотропностью, эффективен при инъекционной остеопластике, как жидкотекучий, максимально дефектный по структуре в силу аморфности (с наибольшим числом вакансий и замещений в структуре), с размером частиц в гидратной оболочке 30 — 50 нм.
Таким образом, ГАНГ является веществом с максимально развитой активной поверхностью взаимодействия с окружающей костной тканью.
При использовании же в аналогичной ситуации композита «ГАНГ + МПНТ» (мелкогранулированный пористый никелид титана) отмечается интенсификация репаративных процессов в костной ткани с образованием композита «кость — МПНТ». Здесь гранулы никелида титана выполняют каркасообразующую функцию для растущих трабекул кости. Верхнечелюстная кость при этом регенерирует несколько быстрее, чем нижнечелюстная, в силу ангиотрофических особенностей, однако микротравма альвеолярных отростков в ходе повторной остеотомии во всех случаях приводила к усилению кровотока и ускорению остеогенеза.
Гистоморфологический анализ кости, извлеченной в процессе проведения имплантации в участках остеопластики, выявил органотип образцов, а R-контроль — повышенную плотность костной ткани.
Результаты проведения описанной выше остеопластики рассмотрим на клиническом примере.
Пациентка К., 45 лет.
Постцистэктомические дефекты переднебоковых отделов верхних челюстей со значительным сужением альвеолярных отростков. Ниже приводится выписка из томографического исследования до пластики (рис. 4).
21.02.2015 19:56
Исследование верхней челюсти
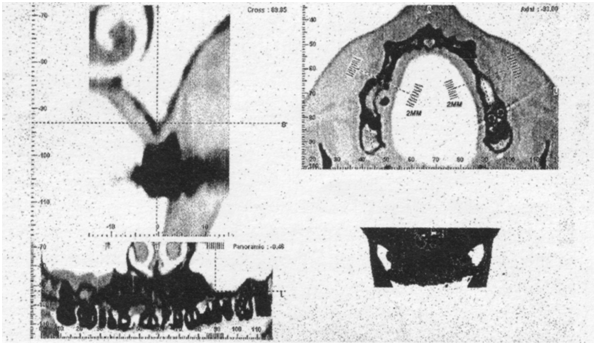
|
На уровне 15-го зуба альвеолярный отросток конической формы, очень узкий. Вертикальный размер — 7 мм, ширина гребня около 2 мм.
На уровне 14-го зуба вертикальный размер челюсти 11 мм, ширина — 2 мм.
Канал корня 13-го зуба пломбирован до верхушки корня. Периодонтальная щель минимально расширена до 1 мм.
На уровне отсутствующего 12-го зуба — вертикальный размер альвеолярного отростка 20 мм, ширина гребня 4 мм, но в середине отростка он сужен в передне-заднем направлении до 3 мм.
На уровне 24-го, 25-го, 26-го отсутствующих зубов альвеолярный отросток резко атрофичен.
На уровне 24-го зуба высота альвеолярного отростка 10 мм, гребень сужен до 2 мм на основании.
На уровне 25-го, 26-го зубов альвеолярный отросток представлен пластинкой толщиной в 1 мм; конически-заостренный на уровне гребня.
Пациентка К., 45 лет.
Через шесть месяцев от начала лечения. Увеличен объём костной ткани, значительно повышена плотность кости. Ниже приводится выписка из томографического исследования после пластики (рис. 5).
15.12.2015 10:01
Исследование верхней челюсти
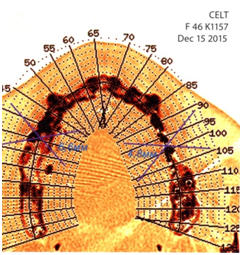
|
13-й — в канале рентгенопозитивный материал, периодонтальные ткани не изменены.
14-й — отсутствует, пластика отростка искусственной костью высокой плотности, толщина собственной кости 2 — 2,8 мм, расстояние до синуса 10 мм, толщина после пластики — 5,7 мм, высота 14,7 мм.
15-й — отсутствует, пластика отростка искусственной костью высокой плотности, толщина собственной кости 3,8 мм, расстояние до синуса 5,8 мм, толщина после пластики 6,6 мм, высота 7,2 мм.
16-й — медиальный корень полностью обнажен, вестибулярные по боковой поверхности отростка прикрыты искусственной костью толщиной 1,8 мм, толщина отростка 7,2 мм, расстояние до синуса 7,7 мм.
24-й — отсутствует, пластика отростка искусственной костью высокой плотности, толщина собственной кости 3,6 мм, толщина после пластики 4,8 мм, высота 10,9 мм.
25-й — пластика отростка искусственной костью высокой плотности, толщина после пластики 6,6 мм у основания конуса, высота конуса 5,9 мм, расстояние до синуса 5,9 мм.
26-й — отсутствует, пластика отростка искусственной костью высокой плотности, толщина 6,9 мм в основании конуса, высота конуса 6,1 мм, расстояние до синуса 6,1 мм, толщина искусственной кости 3,8 мм.
Ниже приводится пример применения функциональной остеопластики (рис. 6).
Пациентка П., 44 года.
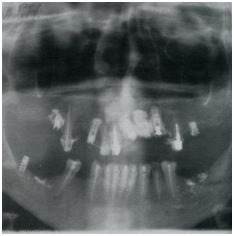
|
На ОПГ видны активированные дистракторы в различных участках на разных этапах остеопластики.
Заключение
Предлагаемый способ позволяет увеличить объём костной ткани на любом участке челюсти при любом возрасте пациента и не имеет противопоказаний.
В ряде случаев данный метод позволяет одновременно увеличить объём костной ткани и провести имплантацию. Наличие различных по длине и диаметру остеотомов даёт возможность провести туннелизацию кости с минимальной травмой надкостницы, что ускоряет репарацию кости. Активация дистрактора практически безболезненна и, при определённом навыке, осуществляется самим пациентом.
Результаты наблюдений показывают надёжность и эффективность данного метода остеопластики в амбулаторных условиях.
Литература
1. Гурфинкель Л. Н. Некоторые аспекты имплантологии в XX — XXI веке. // Стоматолог-практик — № 12, 2005. С. 34 — 35.
2. Гюнтер В. Э. с соавт. Никелид-титан. Медицинский материал нового поколения. — Томск: МИЦ, 2006. С. 296.
3. Гизатуллин Р. М. Лечение деструктивных форм хронического периодонтита комбинацией пористого никелида титана с остеопластическим препаратом «КоллапАН-гель». Сборник «Биосовместимые материалы с памятью формы и новые технологии в стоматологии». — Томск: Изд-во «НПП МИЦ», 2006. С. 76 — 79.
